Les FAQ ci-dessous ont pour but de vous guider dans la nouvelle procédure d’enregistrement auprès de l’AFMPS en tant qu’acteur du secteur des dispositifs médicaux.
Questions générales
Les différentes activités possibles sont définies ci-dessous. Vous les retrouverez dans les applications en ligne lors de votre enregistrement.
Ces définitions d’activités sont basées sur les définitions européennes reprises dans les règlements européens : 2017/745 pour les dispositifs médicaux et 2017/746 pour les dispositifs médicaux de diagnostic in vitro.
Vous pouvez combiner plusieurs activités. Par exemple, vous pouvez agir comme fabricant pour les dispositifs que vous mettez sur le marché en votre propre nom et comme distributeur pour les dispositifs mis sur le marché au nom d’un tiers.
Afin de savoir si vous devez vous enregistrer ou non dans nos applications en ligne, veuillez être certain des activités que vous effectuez suivant les définitions ci-dessous.
1. Fabricant de dispositifs médicaux
La définition de fabricant se trouve à l’ article 2, 30, du règlement 2017/745 relatif aux dispositifs médicaux et à l’article 2, 23 du règlement 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro:
« fabricant » : une personne physique ou morale qui fabrique ou remet à neuf un dispositif ou fait concevoir, fabriquer ou remettre à neuf un dispositif, et commercialise ce dispositif sous son nom ou sous sa marque.
Un fabricant n’est donc pas considéré comme distributeur lorsqu’il met ses propres produits à disposition sur le marché.
Si vous fabriquez des dispositifs sur mesure veuillez vous référer à l’activité fabricant de dispositifs sur mesure.
2. Fabricant de dispositifs sur mesure
La définition de fabricant se trouve à l’ article 2, 30, du règlement 2017/745 relatif aux dispositifs médicaux et à l’article 2, 23 du règlement 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro:
« fabricant » : une personne physique ou morale qui fabrique ou remet à neuf un dispositif ou fait concevoir, fabriquer ou remettre à neuf un dispositif, et commercialise ce dispositif sous son nom ou sous sa marque.
Un fabricant n’est donc pas considéré comme distributeur lorsqu’il met ses propres produits à disposition sur le marché.
La définition de « dispositif sur mesure » se trouve à l’article 2, 3) du règlement (UE) 2017/745 :
« dispositif sur mesure », tout dispositif fabriqué expressément suivant la prescription écrite de toute personne habilitée par la législation nationale en vertu de ses qualifications professionnelles, indiquant, sous sa responsabilité, les caractéristiques de conception spécifiques, et destiné à n'être utilisé que pour un patient déterminé et exclusivement en réponse aux besoins et à l'état de santé de ce patient
3. Assembleur de systèmes et nécessaires
Est considérée comme un assembleur de systèmes et nécessaires (article 22 du règlement européen 2017/745):
Toute personne physique ou morale qui associe des dispositifs portant un marquage CE avec les autres dispositifs ou produits suivants, d'une manière qui soit compatible avec la destination des dispositifs ou autres produits et dans les limites d'utilisation précisées par leurs fabricants, en vue de les mettre sur le marché sous la forme d'un système ou d'un nécessaire: a) d'autres dispositifs portant le marquage CE; b) des dispositifs médicaux de diagnostic in vitro portant le marquage CE conformément au règlement (UE) 2017/746; c) d'autres produits conformes à la législation applicable à ces produits, uniquement s'ils sont utilisés dans le cadre d'une intervention ou si leur présence dans le système ou le nécessaire se justifie d'une autre manière.
4. Représentant autorisé d’un fabricant de dispositifs médicaux
La définition de représentant autorisé ou mandataire est mentionnée à l'article 2, 32 du règlement 2017/745 relatif aux dispositifs médicaux et à l’article 2, 25 du règlement 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro
« mandataire » : toute personne physique ou morale établie dans l'Union ayant reçu et accepté un mandat écrit d'un fabricant, situé hors de l'Union, pour agir pour le compte du fabricant aux fins de l'accomplissement de tâches déterminées liées aux obligations incombant à ce dernier en vertu du règlement. Un représentant autorisé ou mandataire agit au nom du fabricant selon les termes du contrat qui les lie et doit donc suivre les mêmes instructions que celles données au fabricant.
Un représentant autorisé est considéré comme distributeur s’il distribue les dispositifs qu’il représente.
Un représentant autorisé est considéré comme importateur s’il importe les dispositifs qu’il représente.
Veuillez-vous référer à l’activité importateur ou distributeur de dispositifs.
5. Distributeur de dispositifs médicaux
La définition de distributeur se trouve à l’ article 2, 34, du règlement 2017/745 relatif aux dispositifs médicaux et à l’article 2, 27 du règlement 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro:
3° « distributeur » : toute personne physique ou morale faisant partie de la chaîne d'approvisionnement, autre que le fabricant ou l'importateur, qui met un dispositif à disposition sur le marché, jusqu'au stade de sa mise en service.
Un distributeur est donc un acteur, autre que le fabricant et l’importateur, qui met à disposition des dispositifs médicaux sur le marché de l’Union européenne.
Si vous mettez sur le marché des dispositifs médicaux que vous fabriquez ou des dispositifs médicaux mis sur le marché en votre propre nom, veuillez vous référer à l’activité fabricant de dispositifs médicaux.
Remarque : le détaillant est défini comme un distributeur.
6. Exportateur de dispositifs médicaux
Pour les dispositifs médicaux la notion d’ « exportateur » a été abrogée par l’arrêté royal du 28 avril 2021 modifiant et abrogeant diverses dispositions en matière de dispositifs médicaux.
L’enregistrement en tant qu’exportateur n’est plus obligatoire. Néanmoins il est toujours possible de s’enregistrer sur le web portail en tant qu’exportateur, ce qui ouvre l’accès à l’application « mes certificats de libre vente » qui permet la demande de certificats de libre vente électroniques pour les dispositifs mis sur le marché sous les directives.
Pour les dispositifs mis sur le marché sous les règlements (UE) 2017/745 et 2017/746, seuls les fabricants et les mandataires peuvent faire des demandes de certificats de libre vente.
7. Importateur de dispositifs médicaux
La définition de distributeur se trouve à l’ article 2, 33, du règlement 2017/745 relatif aux dispositifs médicaux et à l’article 2, 26 du règlement 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro:
« importateur » : toute personne physique ou morale établie dans l'Union qui met un dispositif provenant d'un pays tiers sur le marché de l'Union.
Un importateur est donc un opérateur qui met à disposition des dispositifs médicaux provenant d’un pays situé en dehors de l’Union européenne.
8. Etablissement de santé
La définition de distributeur se trouve à l’ article 2, 36, du règlement 2017/745 relatif aux dispositifs médicaux et à l’article 2, 29 du règlement 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro:
« établissement de santé », une entité ayant pour mission première de prendre en charge ou soigner des patients ou d'œuvrer en faveur de la santé publique.
Les établissements de santé ont accès au web portail afin d’y enregistrer ses activités de fabrication de dispositifs « in-house » ou de retraitement de dispositifs à usage unique (reprocessing) ainsi que les dispositifs qui sont associés à ces activités.
9. Service et assistance technique à domicile (STHA)
Sont considérées comme STHA (article 59 de la loi en matière de dispositifs médicaux)
Les entreprises qui, dans le cadre d'un traitement médical d'un patient en dehors d'un hôpital, installent et/ou maintiennent des dispositifs médicaux.
L’enregistrement se fait via notre web portail.
Des manuels d’utilisation sont à disposition sur ce portail afin de vous guider dans l’enregistrement de votre entreprise :
Entreprises basées en Belgique
Entreprises basées en dehors de la Belgique
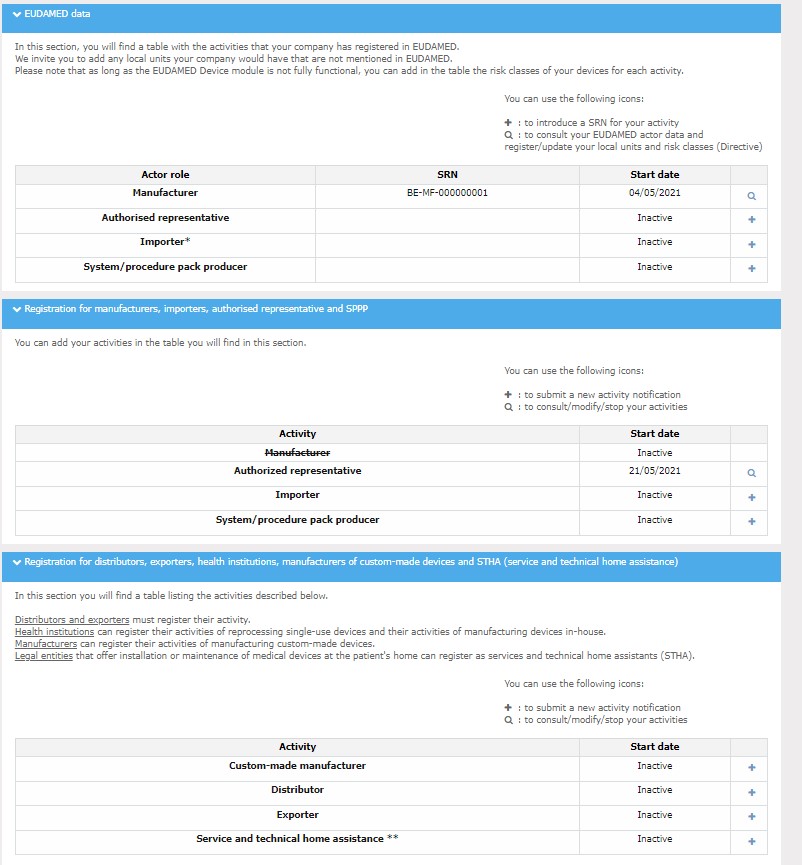
Dans l’application Mes activités, vous devez vous enregistrer sous votre/vos propre(s) activité(s). Pour que votre enregistrement à l’AFMPS soit complet vous devez notifier au moins une activité. Un numéro AFMPS sera ensuite attribué automatiquement à votre entreprise.
Dans l’application le « + » à côté de chaque activité permet d’ajouter cette activité et d’ouvrir le formulaire concerné.
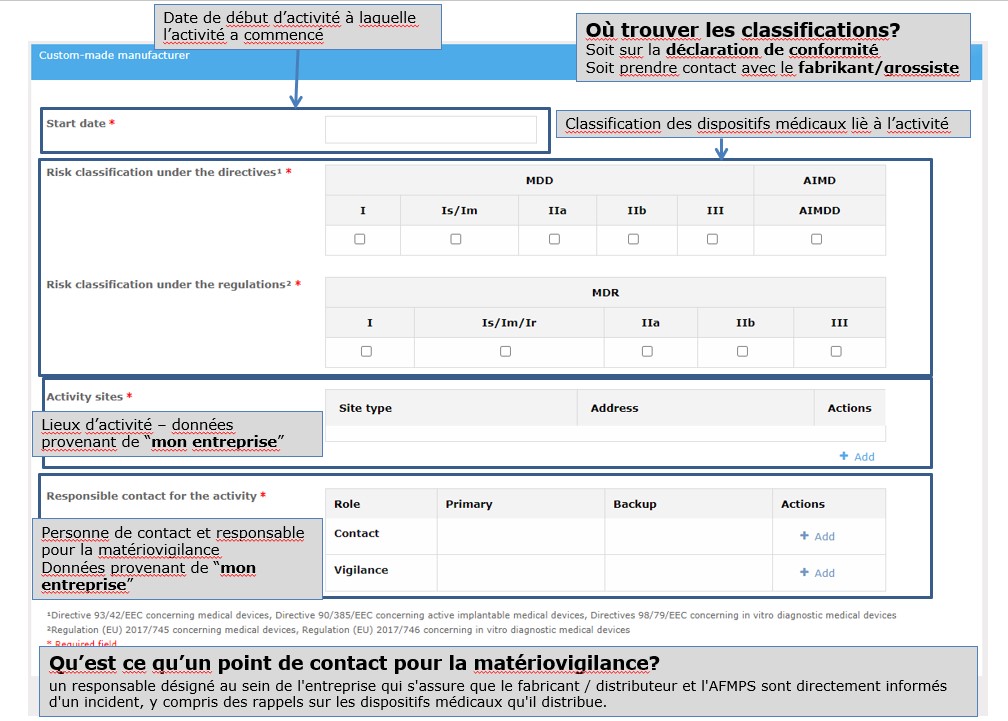
Une fois le formulaire de notification de l’activité ouvert, vous devez compléter les différents éléments demandés .
Une fois le formulaire complété, cliquez sur « soumettre la notification ».
Nous restons à votre disposition pour toute question relative à ce nouveau système via
pour des questions techniques support.portal@afmps.be
pour toutes autres questions notifications.meddev@fagg-afmps.be
En tant que distributeur, vous serez également amené(e) à remplir les informations concernant les fabricants et représentants autorisés des dispositifs médicaux que vous mettez à disposition. Ces informations doivent être enregistrées dans l’application « Mes fabricants ».
Pour chaque activité, vous êtes invité(e) à remplir un formulaire d’autocontrôle dans l’application « Mes contrôles ». Ce formulaire permet de faire une analyse de risque. L’application « Mes contrôles » permet également une meilleure communication entre l’inspecteur et vous.
Ce formulaire d’autocontrôle est obligatoire pour les distributeurs.
Conformément à l’article 6 de l’arrêté royal du 7 avril 2019 portant exécution de l'article 35septies de la loi relative à l'assurance obligatoire soins de santé et indemnités, coordonnée le 14 juillet 1994, concernant la notification d'implants et de dispositifs médicaux invasifs pour usage à long terme, le demandeur doit fournir le(s) numéro(s) de notification attribué(s) par l'Agence fédérale des médicaments et des produits de santé aux distributeurs des dispositifs.
Le demandeur est défini à l’article 1er, 5°, de ce même arrêté :
5° « Demandeur » : l'entreprise qui met ou a mis un implant sur le marché belge.
Le demandeur doit donc se faire connaitre auprès de l’AFMPS pour pouvoir prétendre à un remboursement des dispositifs médicaux qu’il met à disposition. Les fabricants, les importateurs et les distributeurs de dispositifs médicaux invasifs à long terme et d’implants qui demandent un remboursement à l’INAMI doivent s’enregistrer dans les applications en ligne et de notifier les dispositifs médicaux concernés dans le portail Web. Vous pouvez trouver quelles dispositifs médicaux relèvent de cela sur le site Web de la RIZIV procédure de notification.
Nous vous invitons à vous enregistrer sur base volontaire même si légalement vous n’êtes pas obligé(e) de le faire. Vous recevrez dès lors des communications ciblées et rapides, en fonction des activités que vous aurez enregistrées. Ces communications concernent par exemple les prochaines applications que nous développerons, des informations sur le futur règlement, des formations à thème ...
Cet enregistrement permettra également d'améliorer et d'accélérer les procédures administratives avec l'AFMPS.
De plus, votre enregistrement vous permettra de gérer plus facilement les inspections dans l’application Mes contrôles. La fréquence de ces inspections est basée sur une analyse de risque qui tient compte de différents paramètres comme l’enregistrement dans nos applications et le respect des guides écrits par le secteur représentatif de l’activité. Mes contrôles sert également d’outil de communication entre vous et votre inspecteur responsable.
Bien entendu ! Vous pouvez toujours vous inscrire sur le portail internet de l'AFMPS, même si votre entreprise est basée en dehors de la Belgique. En vous enregistrant, vous resterez informé(e) des activités de l'AFMPS dans le cadre des dispositifs médicaux.
Questions techniques
Cela signifie que vous n’avez pas notifié vos activités (Fabricant, distributeur, etc.) via l’application « Mes activités ». Nous vous invitons à vous connecter sur le portail et à notifier vos activités.
Pour avoir accès aux applications fédérales belges, un citoyen non belge a besoin d'un numéro NISS qui correspond au numéro national. Ce numéro commence par l'année de naissance, le mois de naissance + 40 ans et puis 5 chiffres. Ce numéro est demandé au service Limosa.
Assurez-vous que vous avez accès à l’application « Source Authentique des dispositifs médicaux » décrit au point 3.2.2 - Figure 19.
Les e-mails d’enregistrements sont envoyés aux responsables légaux de votre entreprise. Si ces derniers n’ont pas reçu ces informations, nous vous invitons à consulter les e-mails indésirables (spams/junk e-mail).
Nous vous invitons à consulter les messages indésirables (spams/junk e-mail).
À défaut, nous vous invitons à redemander un nouveau mot de passe en suivant les étapes décrites au point 4.1 et à cliquer sur le bouton « Forgot Password » Figure 23.
Il faut utiliser le lien “Forgot Password” sur le page de loin
Vous allez recevoir un email avec un lien. Ce lien est active pendant 5 minutes et ne peut qu’ être cliquer une seule fois. Avec ce lien on peut scanner avec le nouveau téléphone le code QR.
Vous pouvez cliquer “Forgot Password” illimité.
La personne doit faire le nécessaire pour obtenir le numéro NISS auprès du service Limosa. Ensuite, ajoutez la personne dans la liste des utilisateurs sur CSAM en suivant les étapes décrites au point 3.2.2.
Assurez-vous que la qualité « Institution liée au domaine de la santé » est activée (voir point 3.2.1) et ensuite suivez les étapes décrites au point 3.2.2.
Voir ce lien.
Non, ce n'est pas possible. Seule la carte d'identité belge peut être utilisée.
Cette procédure peut prendre environ quinze jours.
Ce numéro a été envoyé par courriel au(x) responsable(s) légale(-aux) de l’entreprise lors de l’enregistrement de l’entreprise sur le portail de l’AFMPS.
Pour les belges, cette information se trouve au dos de la carte d’identité électronique.
Désinstallez l’application d'identification et d’authentificateur TOTP
Soit réinstallez une autre application d’authentification (Google Authenticator/Microsoft Authenticator/Authy/etc.) et ensuite, synchronisez les fuseaux horaires. Exemple de Google Authenticator : accédez au menu principal de l'application Google Authenticator -> onglet Autres paramètres -> onglet Correction du temps pour les codes -> onglet Sync maintenant.
Soit installez l'authentificateur sur une autre machine : utilisez https://authy.com/ pour l'installer et le tester.
Cette erreur peut avoir trois causes :
- Parfois l’autorisation de l’accès venant de la sécurité sociale n’est pas envoyée vers nos applications directement. Il faut attendre le lendemain pour pouvoir se connecter.
- Votre entreprise n’as pas la qualité « Institution liée au domaine de la santé » (voir point 3.2.1).
- Vous n’êtes pas désigné comme gestionnaire ou utilisateur de nos applications (voir point 3.2.2).
- Si toutes les actions ci-dessus n’ont pas résolu le problème, veuillez nous envoyer un e-mail avec la capture d’écran de la sécurité sociale et avec vos accès.
Oui, vous devez vous inscrire à nouveau. Toute la procédure d’enregistrement et de notification d’un acteur a été modifiée. Cette nouvelle procédure est totalement gratuite.
Pour toute question technique relative à l'utilisation du web portail, vous pouvez contacter le support technique du portail à l'adresse email support.portal@afmps.be ou par téléphone au +32 2 528 48 56.